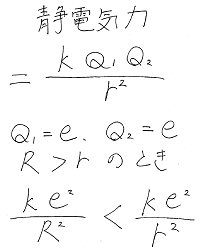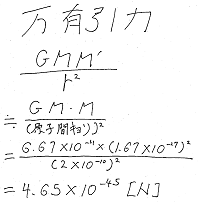★千葉中央駅校開校!Instagramはじめました★
フォローお願いします👇
https://www.instagram.com/premium_chibachuou
大学受験のあれこれを投稿していきます☆
=======================
こんにちは。
八千代緑が丘校の轟です。
生徒から化学についての融点についての質問から
始まったこのシリーズですが今日で最終話。
=============================
第1話:融点の周期性
http://www.jasmec.co.jp/cgi-bin/diaryopen/diaryopen02/diary.cgi?no=2937
第2話:原子間の結合をもたらしているものは何?
http://www.jasmec.co.jp/cgi-bin/diaryopen/diaryopen02/diary.cgi?no=2939
第3話:結合の始まりは共有結合から
http://www.jasmec.co.jp/cgi-bin/diaryopen/diaryopen02/diary.cgi?no=2940
第4話:共有結合 ⇒ 金属結合
http://www.jasmec.co.jp/cgi-bin/diaryopen/diaryopen02/diary.cgi?no=2942
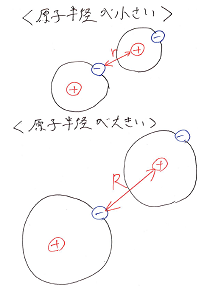
第5話:なぜアルカリ金属は大きくなると結合力が弱くなるの?
http://www.jasmec.co.jp/cgi-bin/diaryopen/diaryopen02/diary.cgi?no=2943
=============================
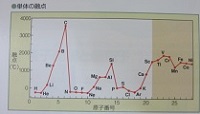
第1話で融点の周期性の特徴として
⑤17族元素(ハロゲン)、18族元素(希ガス)の単体の融点は
原子番号が大きくなるに従って高くなる。
これは、原子番号が大きくなるに従って分子が大きくなり、
分子間力が強くなるからである。
と書きました。
分子が大きくなると、分子間力が強くなるのは
「なぜだろう?」と疑問に思ったりしませんか?
もし仮に分子間力を生じる要因が万有引力であれば
分子が大きくなり、質量が増えると共に
引力が強くなることは自明ですが、
分子同士をつなぐ主な引力も万有引力ではなく
静電気力です。
そこで今回は、まずは分子同士が引き合うメカニズム
についてお話しする中で、分子の大きさと
分子間力の関係性について書きたいと思います。
===========================
<八千代緑が丘 校舎紹介ページ>
http://www.jasmec.co.jp/koushaguide/pym.htm
八千代緑が丘校ではいつでも無料で個別学習相談
を行っています。
勉強で困っていることのある方はいつでもおっしゃって下さい。
個別学習相談のお申込みはこちらから👇
https://www.jasmec.co.jp/toshin/reserve/premium_reserve.htm
===========================
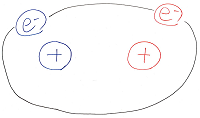
分子は全体として電荷を持っていませんから
陽イオン―陰イオン間で働くような
強い静電気力が分子間で働くことはありません。
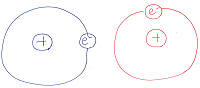
しかし、分子はミクロに見れば原子核と
動き回る電子の集合体ですから、
分子の各所に瞬間的に、または時間平均的に
δ+とδ-が生じ、その結果、分子間にも
力が作用することになります。
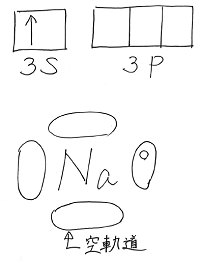
ちなみに、分子の中にδ+とδ-が生じる要因は
二原子間で軌道が合体し、電子2個共有されても
電気陰性度の大きい元素の方に電子が偏り、
δ+の部分とδ-の部分が生じるためです。
分子の形に対称性があり、δ+とδ-の中心が一致し、
この種の引力が打ち消し合う分子があります。
それを無極性分子といいます。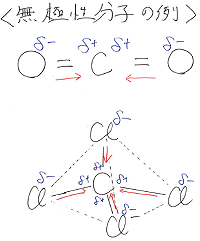
一方、分子の形に対称性がなく、引力が打ち消し合わない
分子を極性分子といいます。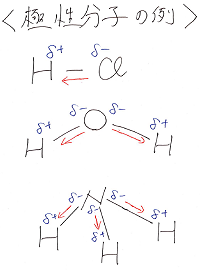
無極性分子、極性分子に関わらず、
ある瞬間をとってみれば分子の各所で
δ+、δ-の状態が存在し、
各瞬間ごとに引力が生じるような電子の配置が
起こりやすいため、分子間に引力が生じる
ことになります。
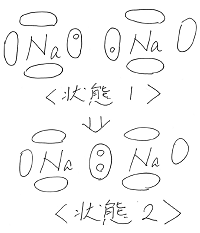
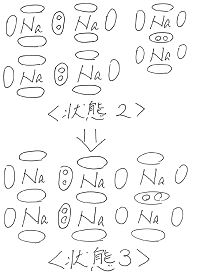
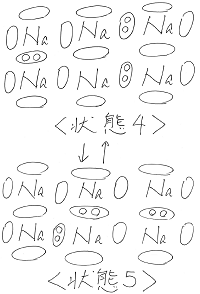
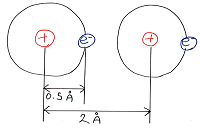
ここで、2つの棒のような形状の分子同士が
近づいたことを考えてみます。
分子はそれぞれ回転しているため、
接近したときに、分子の位置関係のパターンは
無数の状態が考えられます。
その中でも特徴的なパターンである状態1~状態3
を下図のように考えてみました。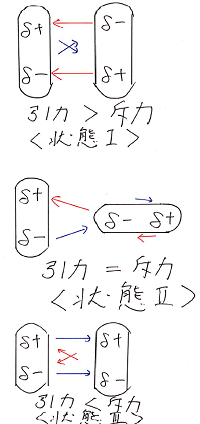
(→は左側の分子が右側の分子に及ぼす力の
向きと大きさを表しています。)
様々な状態をとり得るのですが、
一般に、引力が生じ、ポテンシャルエネルギー的に
安定な状態ほど分子の存在確率が高くなるため、
状態1やそれに近い状態が実現しやすく、
分子間には全体として引力が生じることになります。
この引力が分子間力です。
この分子間力は、瞬間のδ+、δ-を生じさせる原因となる
電子が多ければ多い程、強い力となります。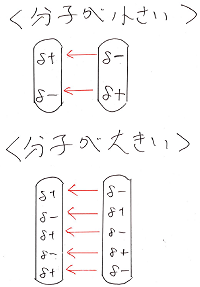
電子数は陽子数と等しく、陽子数が大きい程分子量も大きいため
分子間力は分子量が大きい程大きくなると言えます。
以上をまとめますと
17族元素(ハロゲン)、18族元素(希ガス)の単体は分子を作り、
分子間力で分子同士がつながっていますが、
分子内にδ+、δ-を生じさせる要因となる電子の数が
多くなる程、つまり原子番号が大きくなる程、
つまり分子量が大きくなる程、分子間力が強くなり、
融点が高くなることがわかります。
以上、全6回を通して、単体の融点の周期性のメカニズムを
お話ししてきました。
何か新しい発見があれば幸いです。
中には読みづらい箇所や理解しづらい箇所があったと
思いますが、最後まで読んで下さったそこのあなた、
ありがとうございます。
頭が疲れたと思いますので癒しの1枚。
これは暑い真夏のある日、
猫がいびきをかいて寝ていました。
とってもかわいかったので思わず撮った1枚です。
何か気になることがあるということがあったら
またブログで書かせて頂きたいと思いますので
質問があったらいつでもお待ちしております。
(八千代緑が丘校 轟)
=======================
★一日体験・個別説明会受付中!★
詳細・お申込みはこちらから👇
https://www.jasmec.co.jp/toshin/reserve/premium_reserve.htm